
酸化還元反応のイメージを聞くと、「解き方がわからない」「半反応式が苦手」などの声がよく聞かれます。
実際、酸化還元反応はポイントを掴めていないと数多くのことを覚えなければいけません。
でもポイントを掴めばあっという間に覚えることが出来ます。
そして覚えることができれば計算問題も楽勝に解けます。
覚えることを怠ると計算問題は解決できません。
今回は、そんな酸化還元反応の【絶対覚えるべきこと】と【計算問題のコツ】を教えます。
酸化還元反応:絶対覚えるべきこと
1.酸化と還元の定義
電子の移動に着目して覚えていきましょう。
・酸化…電子を失うこと
・還元…電子を受け取ること
・酸化剤…相手を酸化する(相手から電子を奪う)=自らは還元される(自らは電子を受け取る)
・還元剤…相手を還元する(相手に電子を与える)=自らは酸化される(自らは電子を失う)
★酸化と還元は同時に起こる
「酸化剤」と「還元剤」の定義がなぜ上記(相手を~する)のようになるのかが理解できない人は次のように考えてみて下さい!
たとえば洗剤。
洗剤自身は洗われるのではなく「相手を洗う」作用をもちます。
このように「酸化剤」も酸化剤自身は酸化されるのではなく「相手を酸化する」という意味なのだと思えば楽勝です!
>>1ヶ月で早稲田慶應・難関国公立の英語長文がスラスラ読めるようになる方法はこちら
2.代表的な酸化剤と還元剤
計算問題を解く時、どの物質が酸化剤でどの物質が還元剤なのかを素早く判断する必要があります。
以下の酸化剤・還元剤は半反応式を含め必ず覚えましょう(教科書や図表も参考にしましょう)。
まずは赤文字を覚える(たとえば、MnO4-→Mn2+)、その他は以下のように作っていきます。
| 酸化剤 | 過マンガン酸カリウム | MnO4- + 8H+ + 5e- → Mn2+ +4H2O (酸性中) |
| 過酸化水素 | H2O2 + 2H+ + 2e- → 2H2O | |
| ニクロム酸カリウム | Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O | |
| オゾン | O3 + 2H+ + 2e- → O2 + H2O | |
| 二酸化硫黄 | SO2 + 4H+ + 4e- → S + 2H2O | |
| 希硝酸 | HNO3 + 3H+ + 3e- → NO + 2H2O | |
| 濃硝酸 | HNO3 + H+ + e- → NO2 + H2O | |
| 熱濃硫酸 | H2SO4 + 2H+ + 2e- → SO2 + 2H2O |
希硝酸はHNO3→NOでOが1個、濃硝酸はHNO3→NO2でOが2個と覚えよう!
| 還元剤 | 過酸化水素水 | H2O2 → O2 + 2H+ + 2e- |
| シュウ酸 | (COOH)2 → 2CO2 + 2H+ + 2e- | |
| 硫化水素 | H2S → S + 2H+ + 2e- | |
| 塩化スズ(Ⅱ) | Sn2+ → Sn4+ + 2e- | |
| ヨウ化カリウム | 2I- → I2 + 2e- | |
| チオ硫酸ナトリウム | 2S2O32- → S4O62- + 2e- | |
| 二酸化硫黄 | SO2 + 2H2O → SO42- + 4H+ + 2e- |
~式の作り方~
①赤文字を覚える
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
②両辺の酸素原子の数をそろえるため H2Oで補う
MnO4-→ Mn2+ + 4H2O
③両辺の水素原子の数をそろえるため 水素イオンH+で補う
MnO4- + 8H+ → Mn2+ + 4H2O
④両辺の総電荷をe-で合わせる
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
★赤文字は絶対に覚えましょう。
その後は、酸素原子に着目→水素原子に着目→総電荷に着目 の順番です。
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
3.酸化還元反応式の作り方
酸化剤・還元剤のはたらきを表す反応式(半反応式)を使って、全体の反応式をつくりましょう。
ポイントは電子e-の数を同じにすることです。
例)酸化剤:過マンガン酸カリウム 還元剤:二酸化硫黄 (硫酸酸性中の反応とする)
MnO4- + 8H+ + 5e- → Mn2+ +4H2O ・・・①
SO2 + 2H2O → SO42- + 4H+ + 2e- ・・・②
①×2+②×5でe-を消します。すると、
2MnO4- + 5SO2 +2H2O → 2Mn2+ + 5SO42- + 4H+
となりイオン反応式の完成です。
あとは両辺に必要なイオンを加えていきます。今回はK+です。
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
酸化還元反応:計算問題のコツ
1.比で解こう
酸化剤のモル:還元剤のモル=酸化剤係数:還元剤係数
例えば、酸化剤が過マンガン酸カリウム、還元剤が二酸化硫黄の場合、イオンン反応式は以下のようになりました。
2MnO4- + 5SO2 + 2H2O → 2Mn2+ + 5SO42- + 4H+
ここから、過マンガン酸カリウムのmol:二酸化硫黄のmol=2:5
ということがわかります。この考え方を利用して問題を解いていきましょう。
例題)0.16mol/Lのシュウ酸水溶液10mLに純水10mLと2.5mol/Lの硫酸10mLを加えた。
ここに、0.10mol/Lのニクロム酸カリウム水溶液を加えるとする。
シュウ酸を完全に酸化するには最低何mL必要ですか。
①酸化剤と還元剤をチェックする。
②文章からそれぞれの情報をまとめ、molを求める。
酸化剤:0.10mol/Lニクロム酸カリウム水溶液 × mL
0.10 mol/L × x/1000L
還元剤:0.16mol/Lのシュウ酸水溶液 10mL
0.16mol/L × 10/1000L
③イオン反応式を作り、酸化剤・還元剤の係数を確認し、比を作成する。
酸化剤 Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O ・・・★
還元剤 (COOH)2 → 2CO2 + 2H+ + 2e- ・・・△
★×1+△×3より、
イオン反応式 Cr2O72- + 3(COOH)2 + 8H+ → 2Cr3+ + 6CO2 +7H2O
よって、ニクロム酸カリウム:シュウ酸= 1 : 3
④比の計算をする
②と③より、 0.10 mol/L × x/1000L : 0.16mol/L × 10/1000L = 1 : 3
となるので、3×0.10× x/1000=1×0.16×10/1000
x =5.33…
≒ 5.3ml
大切なことは、文章題で酸化剤と還元剤の情報を集めること、そしてイオン反応式を作成し比を求めること、これだけです。
>>偏差値が1ヵ月で40から70に!私が実践した「たった1つのワザ」はこちら
2.ヨウ素滴定
ヨウ素滴定はこういう仕組みなのだと覚えておきましょう。
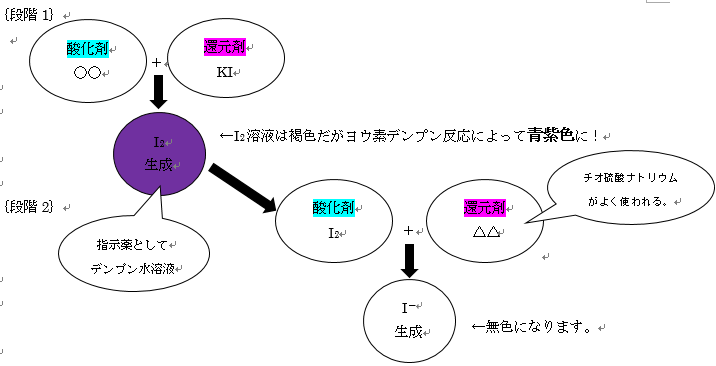
★ヨウ素デンプン反応を理解しましょう。
★段階1、段階2での酸化剤・還元剤に注意しましょう。
応用問題で難しく感じるのは、どれが酸化剤でどれが還元剤かがわかりにくくイメージしにくいためです。
CODなどの問題も同じ流れで実験が行われていますので、まずはパターン化しましょう。
酸化還元反応まとめ
・酸化と還元の定義は電子に着目して覚えましょう。
・有名な酸化剤と還元剤の半反応式は「覚えるべきところ」はきちんと覚える。後の式は作りましょう。
・酸化還元反応式は電子を合わせるだけなので、何度か練習すれば大丈夫です。
・酸化還元反応の計算問題は比で解く!と決め、最後まで比を使いましょう。
・ヨウ素滴定やCODなどはパターンが同じなので問題を何度も解けば大丈夫です。
⇒1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら
現役の時に偏差値40ほど、日東駒専に全落ちした私。
しかし浪人して1ヶ月で「英語長文」を徹底的に攻略して、英語の偏差値が70を越え、早稲田大学に合格できました!
私の英語長文の読み方をぜひ「マネ」してみてください!
・1ヶ月で一気に英語の偏差値を伸ばしてみたい
・英語長文をスラスラ読めるようになりたい
・無料で勉強法を教わりたい
こんな思いがある人は、下のラインアカウントを追加してください!
筆者は現役時代、偏差値40ほどで日東駒専を含む12回の受験、全てに不合格。
原因は「英語長文が全く読めなかったこと」で、英語の大部分を失点してしまったから。
浪人をして英語長文の読み方を研究すると、1ヶ月で偏差値は70を超え、最終的に早稲田大学に合格。
「1ヶ月で英語長文がスラスラ読める方法」を指導中。
⇒【秘密のワザ】1ヵ月で英語の偏差値が40から70に伸びた方法はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら











